真空脱气脱氧的原理及理论计算
真空脱气( 脱氧) 依据原理是亨利定律: 在等温等压下, 某种气体在溶液中的溶解度与液面上该气体的平衡压力成正比。表达式为
p = kc (1)
式中, p 为气体的分压, 单位Pa; k 为亨利常数, 随温度变化, 单位Pa.L/ mol; c 为气体的摩尔浓度, 单位mol/ L。
因此在一定的压力下, 气体在液体中的溶解度与温度成反比; 在一定的温度下, 气体在液体中的溶解度与压力成正比。因此可以通过提高液体温度和降低液面上的压力,使溶解性气体逸出,进行脱气。由于水冷系统的特殊性,采用降压-产生真空的方式可以在较低的温度下使溶于水中气体析出, 从而去除水中的气体。
由于溶氧量可以由溶氧表在线检测, 因此以溶氧量作为系统的监测目标。假设水冷系统的水温为50度 , 可以依据亨利定律, 通过下面步骤计算出氧在标准大气压1.01300*105 Pa 下、50度饱和水中的溶解度。
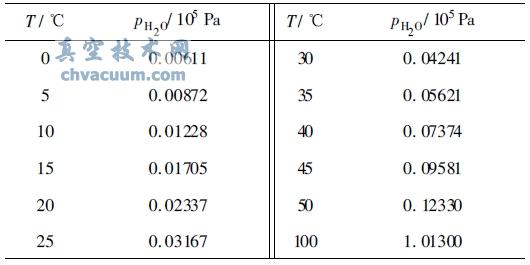
首先从表1 查出水在50 度 时的蒸汽压为0.12330*105 Pa, 由于干空气中氧的含量为20.95%, 所以氧的分压为:
po2= ( 1.01300- 0.12330) *105 X0.2095= 0.1864X105( Pa)
表1 水在不同温度下的分压
亨利常数随温度变化为

式中, 0指的是标准温度(298 K) , C 为常数值, 氧为1280。
已知298 K( 25度) 时亨利常数为1.28X10-8, 代入式( 2) 可得50度时的亨利常数为0.917X10-8。再代入亨利定律式( 1) 即可求出氧在水中的摩尔浓度为1.7094X10-4 mol/ L。氧气的摩尔质量为32g/ mol, 则50 度 时氧气的溶解度为5.47 mg/ L。通过以上步骤可以求出标准大气压下不同温度时氧气在水中的溶解度。如在标准大气压下, 30 度水中的氧的溶解度为7.54 mg/L, 40 度水中的氧的溶解度为6.41 mg/ L。验证了在一定压力下, 气体的溶解度随温度的升高而降低。
压力对氧气在水中溶解度的影响可描述为
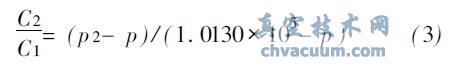
式中, C1, C 2 分别为标准气压和p 2 气压下氧气在水中的溶解度; p 为一定温度下饱和水蒸汽的压力。氧在标准大气压1.01300X105 Pa 下、50度饱和水中的溶解度求得为5.47 mg/L。根据式(3) 可以计算出在50度 时, 当氧气的溶解度为0.2 mg/ L( 200X10- 9) 时的气压p2 为15583.9305 Pa, 即0.01558MPa。同理可求得30度时所需的气压为0.006816MPa, 40 度时所需要的气压为0.010305 MPa。
沸点是液体的饱和蒸汽压等于外界压强时的温度, 液体的沸点跟外部压强有关。当液面压强减小时, 沸点降低。真空脱气使液面压强降低, 可能造成水沸腾。一旦水沸腾, 会有大量水会以水蒸汽的方式被排出, 则系统还需补水。新补进的水同样会带有溶解性气体, 相当于真空脱气方式做无用功。查表2, 对比在不同温度下水中溶氧量为200X10-9时所需的绝对压力, 还未使水沸腾, 保证了真空脱气脱氧的可行性。在50 度 时, 当表压达到- 0.08572MPa 时, 可以实现水中溶氧量为200 X10-9的目标。
表2 饱和水蒸汽的压力与温度关系