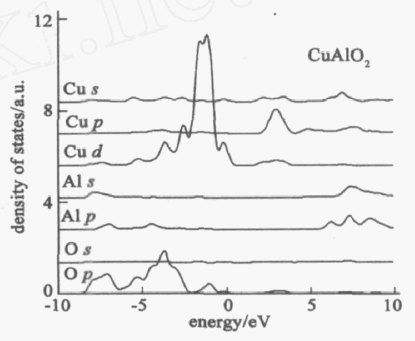
基于石墨烯的光学生物传感器的研究进展
近年来,随着石墨烯研究热潮的兴起,将石墨烯用于生物及化学检测的工作也日益增多。本文着重介绍了基于石墨烯及氧化石墨烯(GO)的光学生物传感器,特别是基于石墨烯的荧光共振能量转移(FRET)传感器以及比色法传感器的设计思想和传感特性。
1、引言
石墨烯是一种由纯碳原子的六元环平面结构构成的二维材料,是零维的富勒烯、一维的碳纳米管(CNTs)以及三维石墨结构的构筑基元。它具有非常大的理论比表面积、很高的杨氏模量、超高的光学透过率、优良的导热性和导电性,并能够通过电子转移实现荧光猝灭。目前,人们已将基于石墨烯的材料广泛应用于诸多领域,如吸附剂、催化剂、药物载体等。石墨烯具有的奇特性质,使得其能够满足高灵敏性传感器设计的需求,并已用于构建光学、电化学及场效应传感器、细胞标记及实时监测等。本文绍了基于石墨烯材料的光学生物传感器的研究进展,重点评述了基于石墨烯基的荧光共振能量转移(FRET)以及比色法传感器。
2、基于石墨烯的荧光共振能量转移传感器
荧光共振能量转移(FRET)是能量由供体荧光团经无辐射途径转移给受体荧光团,并引起供体荧光猝灭和受体荧光增强的光学现象,是测量活体及体外纳米尺度距离及变化的有效手段。近年来,人们致力于开发基于石墨烯材料的FRET传感器,将其用于生物及化学检测。FRET传感器主要由3部分构成:供体、受体(猝灭剂)及供受体之间的桥联媒介。在基于石墨烯的FRET传感器中,石墨烯及其衍生物既可以作为供体,又可作为受体。一方面,石墨烯由于其结构特点,能够同时猝灭发射波长或结构不同的多种荧光团的荧光,是一种通用的猝灭剂;另一方面,石墨烯及其衍生物经过一定的化学处理,可以产生荧光信号,可作为荧光供体。基于石墨烯的FRET生物传感器依托于一些生物分子构建的桥联基,用于调节供体荧光团和受体之间的距离,从而引起荧光的变化。其中,DNA、蛋白质、多肽等生物分子均可以作为桥联基。
2.1、以石墨烯作为猝灭剂
在报道的基于石墨烯材料的FRET传感器中,以石墨烯材料作为猝灭剂的居多。氧化石墨烯(GO)是石墨烯的一种重要衍生物,是化学还原法制备石墨烯的前驱体,在石墨烯片层结构的边缘和表面带有多种含氧基团,如羧基、羟基、环氧基等。正是由于这些含氧基团的存在,使其较石墨烯具有更好的水溶性,可以应用于生物体系中。石墨烯及GO由于其大面积的共轭结构,可以作为能量受体猝灭多种有机染料及量子点的荧光,是一种广适性的荧光猝灭剂。与传统的猝灭剂相比,石墨烯材料具有更高的猝灭效率,使FRET传感器具有背景低、信噪比高、可多重检测的显著特点。
2.1.1、基于DNA联接研究表明,石墨烯能区分多种DNA分子结构,包括ssDNA,dsDNA以及茎环结构等。石墨烯及GO由于其结构特点,对带有裸露的环状结构的化合物具有强烈的吸附能力。
DNA中的碱基包含六元环结构,石墨烯会与裸露的碱基发生强烈的π-π相互作用、疏水作用等,从而吸附DNA。但是石墨烯与不同分子结构的DNA的结合能力明显不同。对于相同碱基数量的单链DNA(ssDNA)和双链DNA(dsDNA),石墨烯能够稳定吸附ssDNA,而对dsDNA的吸附能力则较弱。其原因是由于DNA杂交后空间结构发生改变,磷酸盐骨架将碱基有效屏蔽在其中,使石墨烯无法与碱基接触,从而造成结合能力的减弱。DNA一级结构的差异也会导致与石墨烯的结合能力不同,碱基数量越多的ssDNA与石墨烯材料的结合能力越强。正是基于石墨烯对不同结构的DNA的吸附能力有所区别,研究者们构建了一系列以DNA联接的石墨烯基FRET传感器。
(1)利用DNA互补序列2009年,Lu等首次报道了基于石墨烯的FRET生物传感器。该传感器是由标记了羧基荧光素(FAM)的ssDNA与GO构成。在没有目标DNA时,FAM-ssDNA会吸附到GO表面,造成FAM与GO之间发生FRET,使FAM荧光团的荧光被迅速猝灭;而当FAM-ssDNA与目标DNA杂交后,会改变DNA的构型并且削弱了FAM-ssDNA与GO之间的相互作用,这就造成FAMssDNA从GO表面释放出来,增大FAM与GO之间的距离,阻碍FRET,造成FAM荧光恢复。从而建立了一种用于检测特定DNA序列的高灵敏度及选择性的荧光恢检测方法。该课题组还运用GO作为纳米猝灭剂构建了一种分子信标(MB)探针。传统的分子信标探针两端分别标记荧光团和猝灭团。而这种新型的分子信标探针则只需在一端标记荧光团,而猝灭剂GO则不需要标记。与传统的分子信标相比,该探针不需要复杂的合成步骤,同时猝灭更有效、灵敏度更高。更重要的是,由于发卡状的DNA在GO表面的构象约束大大提高了该探针对单碱基错配的选择性识别能力。其后相继出现了以量子点(QDs)或Ag纳米簇[20]标记的ssDNA探针作为信号报告基团,以GO作为猝灭剂,以类似的模型构建FRET传感器,用于特定DNA序列的检测。GO能够同时猝灭标记ssDNA探针的不同颜色的荧光,可利用此性质识别多种与ssDNA探针互补的特定DNA序列,实现在同一溶液中检测多种特定DNA序列。Zhang等构建了免标记的石墨烯FRET传感器,用于DNA特定序列的检测。当体系中不存在目标ssDNA时,探针ssDNA及所用的DNA嵌插染料(SYBRGreenI,SG)都吸附在石墨烯表面;当引入目标ssDNA时,由于形成dsDNA,并且SG与dsDNA内嵌结合,从而远离石墨烯表面,使荧光恢复。
(2)利用DNA错配DNA在通常情况下遵循碱基互配的原则,即腺嘌呤-胸腺嘧啶(A-T)、鸟嘌呤-胞嘧啶(G-C)配对。但是在某些离子存在情况下,会有错配发生,较为常见的有C-Ag+-C和T-Hg2+-T错配。将DNA错配与石墨烯FRET传感器结合,可以实现特定离子的检测。Wen等利用荧光标记的富含C的ssDNA构建了Ag+的荧光传感器。Ag+的引入可以引起富含C的ssDNA构型的变化,当体系中没有Ag+时,DNA为柔软的单链结构;当有Ag+存在时,C与Ag+发生络合形成C-Ag+-C,DNA链形成刚性的发卡dsDNA结构。DNA结构的改变使DNA与GO的相互作用发生改变,从而引起体系荧光改变。Liu等也构建了类似的平台,利用半胱氨酸(Cys)与C-C错竞争结合Ag+,实现对Cys的检测。他们首先用足量的Ag+使富含C的ssDNA发生折叠,形成dsDNA结构,使体系具有荧光。Cys的加入会夺取C-Ag+-C中的Ag+,使dsDNA结构恢复成ssDNA结构,吸附在GO表面,造成荧光猝灭,其荧光猝灭的程度与Cys的浓度成正比。Zhang等则选用一条标记了荧光且富含T的ssDNA,利用THg2+-T错配,使ssDNA折叠成dsDNA结构,所以Hg2+的加入会使最初较低的荧光信号增强。而碘化物比T-T错配具有更高的与Hg2+结合的能力,碘化物的加入会造成荧光信号的再次猝灭。从而利用GO作为信号变化器,以Hg2+和碘化物作为激活剂构建了一个简单可靠的荧光DNA逻辑门。
(3)利用核酸适配体核酸适配体是一种功能性核酸,它是一段筛选出来的ssDNA序列,能够特异性结合蛋白质、小分子或者离子,可作为便利的传感元件使用。核酸适配体与其特异性目标物结合会使其构型发生改变,单链结构发生折叠,阻碍核酸序列中碱基与石墨烯接触,引起二者距离的改变。例如,选用荧光标记的凝血酶核酸适配体构建FRET传感器用于凝血酶的检测。首先,荧光标记的凝血酶核酸适配体与石墨烯以非共价键结合,发生能量转移,造成体系荧光猝灭;然后向体系中加入凝血酶,该核酸适配体会特异性结合凝血酶,形成四链体-凝血酶结构,该结构与石墨烯的作用力较弱,最终造成体系荧光恢复。这种石墨烯-核酸适配体传感器无论是在缓冲溶液还是血清中均表现出优异的灵敏度和选择性。文献中报道了多种基于石墨烯的核酸适配体FRET传感器,分别用于赭曲霉素A、三磷酸腺苷(ATP)以及粘蛋白(MUC1)等物质的检测。由于核酸适配体能够选择性识别目标物质,区别其它结构类似物,所以核酸适配体传感器都具有较好的选择性,可用于检测稀释的实际样品中的待测物,如稀释的血清、细胞提取液、红酒等。文献中也报道了无标记的核酸适配体传感器。吖啶橙(AO)由于其结构特点能够吸附在还原的GO(rGO)表面,造成AO荧光猝灭。而G-四链体结构的核酸适配体(PS.M)能够捕获吖啶橙,使AO从rGO表面脱离,恢复荧光。但是向AO-PS.M/GO混合液中加入血红素时,PS.M就会与血红素发生特异性结合,释放出AO,AO再次与GO结合导致荧光猝灭。该方法实现了血红素无标记定量检测,检出限为50nmol/L。
(4)利用脱氧核酶(DNAzyme)DNAzyme也是一种功能性核酸,具有催化功能以及识别目标分子的能力。DNAzyme可以与其对应的基底形成DNAzyme-基底杂化体,在特定离子的共同作用下,DNAzyme发挥其催化活性,将基底从断裂位点上剪切开。Zhao等报道了一种基于GO-DNAzyme的Turn-on传感器,用于Pb2+的荧光放大检测。该传感器中以FAM标记的GR-5DNAzyme-基底杂化体作为分子识别模块及信号指示器,以GO作为猝灭剂。GR-5DNAzyme表现出更高的信噪比及更好的选择性。与之相反,Wen等则利用8-17DNAzyme构建了一种Pb2+的Turn-off荧光传感器。同样,采用Cu2+依赖的标记FAM的DNAzyme与石墨烯自组装就可以构建用于检测Cu2+的DNAzyme传感器。文献中也报道了无标记的DNAzyme石墨烯传感器模型。Liu等利用嵌插染料GelRed标记Cu2+依赖的DNAzyme的双链或三链区域。GelRed起初只有微弱的荧光,当插入DNAzyme的双链或三链区域会发出强烈的荧光。当引入石墨烯后,DNAzyme会与GO自组装形成GelRed-DNAzyme-石墨烯复合物,造成荧光猝灭。由于该DNAzyme的催化活性依赖Cu2+,所以当体系中有Cu2+存在时,该DNAzyme会发生断裂,释放出GelRed,导致荧光信号增强。该方法可用于多种待测物的分析。
(5)利用核酸水解酶在核酸水解酶(核酸外切酶或核酸内切酶)的作用下发生的酶切反应会使原有的DNA分子链断裂,从而改变其分子构型。例如,脱氧核糖核酸酶I(DNaseI)是一种核酸内切酶,它能够非特异性将DNA剪切成寡核苷酸;但是DNaseI只作用于ssDNA、dsDNA以及DNA/RNA复合物中的DNA链,却不能作用于RNA。以DNaseI与GO保护的ssDNA探针构成的FRET体系可以用于microRNAs(miRNA)的信号放大检测。其原理是当没有miRNA时,荧光标记的ssDNA探针会吸附在GO上造成荧光猝灭;在加入miRNA后,ssDNA会从GO表面脱附并与miRNA形成复合物,同时荧光恢复。此时,RNA/DNA复合物立即成为DNaseI的消化基底,由DNaseI剪切其中的DNA链,从而释放出
miRNA,释放出的miRNA会与另外的ssDNA探针结合,进入下一轮的剪切循环。该循环一直持续到消耗完所有的探针,所有荧光恢复,达到荧光信号显著放大的作用。这样利用多色荧光标记的ssDNA探针就可同时检测多种不同的miRNA。Lin等以GO和λ核酸外切酶酶切反应为基础建立了一种简单、精确测定多核苷酸激酶(PNK)活性的方法。首先,荧光标记的dsDNA与GO混合时,体系具有荧光。但是当dsDNA被PNK磷酸化后,λ核酸外切酶会立即从末端剪切dsDNA,剪切后的片段就会吸附在GO表面,造成荧光猝灭;反之,如果体系中没有PNK或者PNK活性被抑制,则不会发生剪切反应,体系荧光仍保持。Lee等则利用只剪切dsDNA而不剪切ssDNA的核酸外切酶Ⅲ(ExoⅢ)作用于5'端标记荧光的发卡型DNA。ExoⅢ从3'端剪切dsDNA直至dsDNA尽,只剩ssDNA,从而造成有荧光标记的一段ssDNA序列吸附在GO表面,引起体系荧光猝灭,从荧光猝灭的程度可以衡量核酸外切酶的活性。
(6)其它方法Wu等[39]利用解链温度的差异,设计了一种用于分析DNA磷酸化反应的石墨烯分子信标,该分子信标可以测量T4多核苷酸激酶(PNK)的活性,对单碱基差异具有高特异性识别能力。该实验中用到了两条寡核苷酸(A,B)以及一个发卡序列DNA。其中A,B能够组成与发卡DNA完全匹配的序列,但是A具有5'-羟基端、B两端都为羟基端。当有PNK存在时,A和B两条DNA链会发生连结,与发卡DNA构成稳定的双链结构,该双链结构具有较高的解链温度,在50℃时体系具有较强荧光。但没有PNK存在时,A和B两条DNA与发卡DNA发生杂交,形成有可连结缺口的双链结构,导致该双链DNA的解链温度较低,在50℃时解链形成游离的发卡DNA的荧光会被GO猝灭,基于此原理就可以检测T4PNK的活性。Wu等[40]则利用了DNA的三级结构变化,构建FRET传感器,用于检测猴病毒(SV40)中同型嘌呤同型啶dsDNA结构。这段具有17个碱基对的dsDNA结构很容易与荧光标记的ssDNA结合形成三螺旋DNA,使ssDNA从GO表面脱离,造成体系荧光恢复。Li等[41]利用博来霉素和Fe2+共同作用使ssDNA断裂,造成较短的ssDNA链段从GO表面的释放,使体系荧光增强。该方法能够特异性检测博来霉素的含量。
上文介绍了一系列以DNA结构单一改变为基础的石墨烯FRET传感器。Zhang等充分利用DNA不同的构型变化,在同一溶液中建立了一种多元检测方法。该体系中含有多种荧光标记的DNA探针,包括特定序列的ssDNA、核酸适配体、富含胞嘧啶(C)和富含胸腺嘧啶(T)的ssDNA,每种探针以不同颜色的荧光团标记。利用石墨烯超强的猝灭效率,实现了同一溶液中对多种目标物的同时检测。